CDE定義先進治療藥品新賽道,Cytiva全鏈方案助產業騰飛
2025/06/23
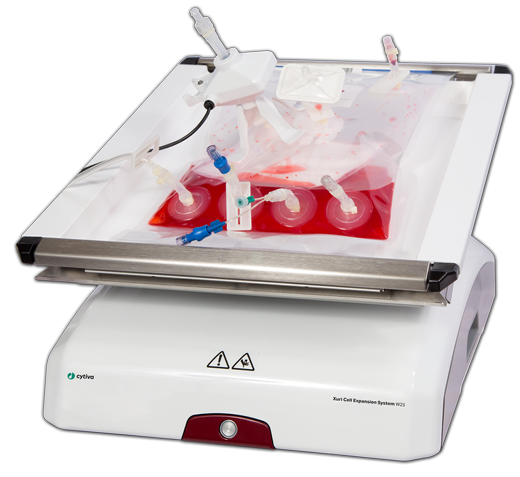
2025年6月10日,國家藥品監督管理局藥品審評中心(CDE)發布 《先進治療藥品的范圍、歸類和釋義(征求意見稿)》,首次在法規層面明確了“先進治療藥品”(Advanced Therapy Medicinal Products,ATMPs)的定義和分類標準。這一監管框架的建立,標志著我國在細胞與基因治療這一前沿領域邁入與國際先進水平“并跑”的新階段。 一、CDE定義先進治療藥品新賽道 CDE將“先進治療藥品”定義為:符合藥品管理規定,按藥品路徑研制生產,經體外操作生產并在人體內發揮預期功能的細胞治療藥品、基因治療藥品,以及采用其他基于微生物、細胞、基因或組織工程等創新技術生產的藥品。這份征求意見稿首次系統構建了我國先進治療藥品的分類體系,將其劃分為三大類別: 細胞治療藥品(CTMPs):包括非基因修飾細胞藥品(如干細胞療法)和體外基因修飾細胞藥品(如CAR-T); 基因治療藥品(GTMPs):涵蓋核酸類藥品(如mRNA藥物)、病毒載體類藥品(如AAV載體療法)、溶瘤微生物類藥品以及基因編輯類藥品; 其他創新類別:包括組織工程藥品、新生抗原類治療藥品等前沿方向; CDE在文件中特別強調,我國對“先進治療藥品”的分類體現了前瞻性和包容性,為新技術/新產品/新模式預留了接口或空間。 二、Cytiva賦能先進治療藥品全鏈條,閉環生產平臺:實現“零暴露”生產 01 Sepax? C-Pro全自動細胞處理系統: 封閉式完成細胞分離、洗滌、配液(適用CAR-T/TIL/NK細胞),避免人工操作污染; 配備多樣化的程序,靈活使用,可滿足不同的應用需求; 全程操作數據可追溯,確保合規的記錄生產數據。 02 Xuri? W25細胞擴增系統: 集成實時監測 + 一次性生物反應袋,確保擴增過程無菌可控; 密度達到 >10 x 106 個細胞/mL,體積最大可達 25 L,可在低強度環境中實現無損液體混合、培養基灌流和有效的氧氣輸送。 Cytiva已構建覆蓋全產業鏈的技術解決方案,推出Sefia細胞治療生產平臺,助力細胞療法的可及性提升。 # END #